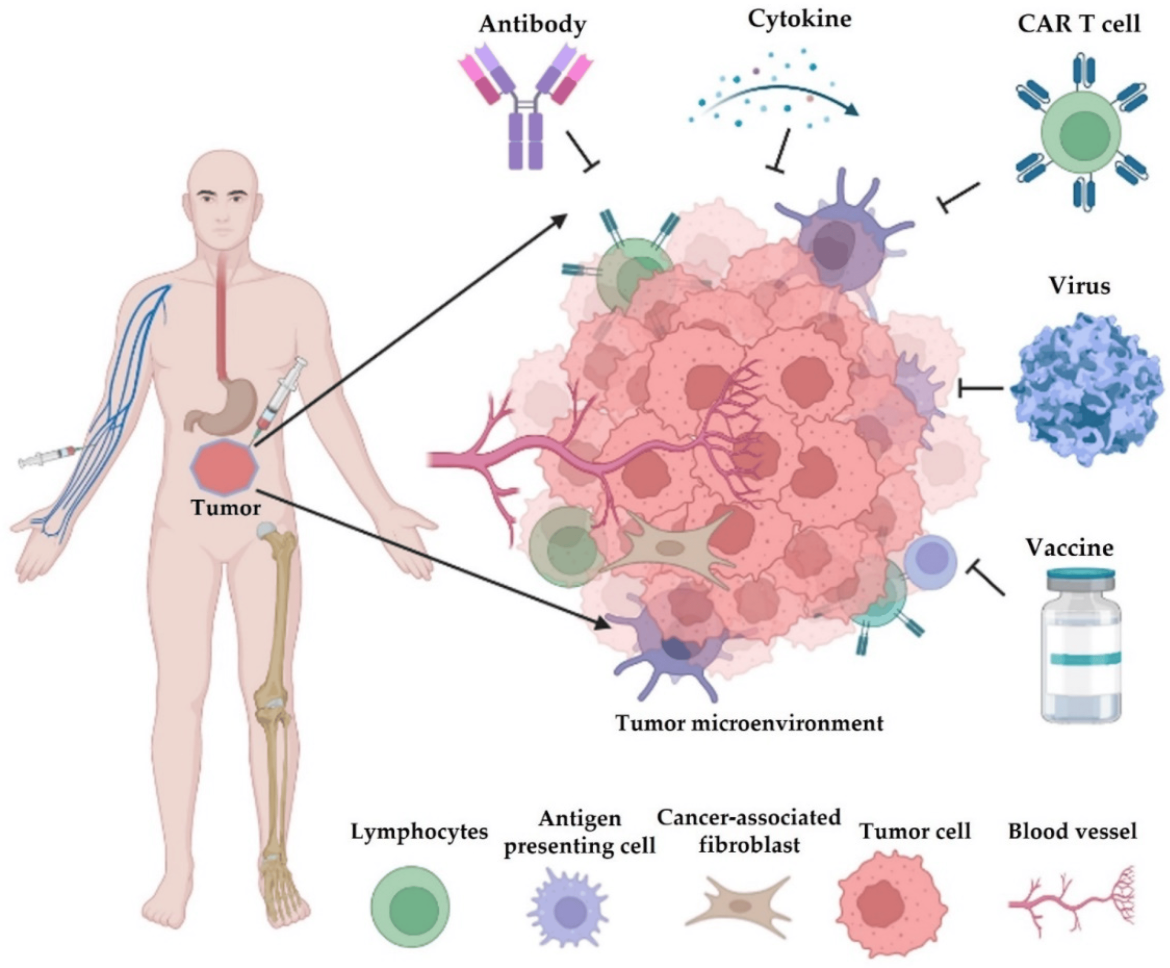
Bağışıklık kontrol noktası inhibitörleri (ICI’ler) son on yılda kanser araştırmalarına farklı bir vizyon kazandırmıştır. Hastanın kendi bağışıklık sistemini hedef alarak onu daha güçlü ve kanserle savaşmak için daha donanımlı hale getirmeyi amaçlayan bu tedaviler, ilerlemiş ve metastatik hastalığı olan hastalar için yeni ve faydalı terapötik seçenekler sağlamıştır.
ICI’ler sınırlı tedavi seçenekleri olan hastalarda uzun vadeli yanıtlar ve kürler sağlayabilirken, önemli zorluklar da ortaya çıkarmaktadır. İlk olarak, farklı hastalar ICI’lara farklı düzeylerde yanıt vermektedir. Dolayısıyla, bir hasta iyileşirken, benzer kanser türüne sahip başka bir hasta yanıt vermeyebilir. ICI’lara verilen farklı yanıtların arkasındaki nedenleri tam olarak anlamamış olsak da, bu konu dünya çapında aktif bir araştırma alanı olmaya devam etmektedir. İkinci olarak, ICI kullanımı bağışıklıkla ilişkili advers olaylar (irAE’ler) olarak bilinen toksisiteleri ortaya çıkarabilir. Bazı hastalarda irAE’ler yönetilebilir ve bu nedenle özellikle anti-kanser etkileri göz önüne alındığında tolere edilebilir. Bununla birlikte, bazı hastalarda kanserden kurtulanların yaşam kalitesini önemli ölçüde engelleyebilecek ciddi irAE’ler görülür. Bazı durumlarda, ciddi ve yaşamı tehdit eden irAE’ler tedavinin kesilmesini bile gerektirebilir.
Yakın zamanda Klinik ve Deneysel Kanser Araştırmaları Dergisi’nde yayınlanan klinik öncesi bir çalışma, bu zorlukların her ikisiyle de yüzleşmeye yardımcı olabilecek potansiyel bir rejimi araştırıyor. Araştırmacılar, ICI’ların doğrudan lenf düğümünü (LN) hedeflemesi halinde hem anti-tümör yanıtını artırabileceği hem de ilişkili irAE’leri azaltabileceği varsayımında bulunmuştur.
Araştırmacılar LN’ye metastaz yapan fare osteosarkom hücrelerini (LM8) kullanmışlardır. Çalışmada kullanılan fareler, lenfatik ağ boyunca tümörlerin manipülasyonuna ve görselleştirilmesine izin veren genişlemiş LN’ler ile karakterize bir durum olan lenfadenopati ile sonuçlanan genetik bir mutasyona sahiptir.
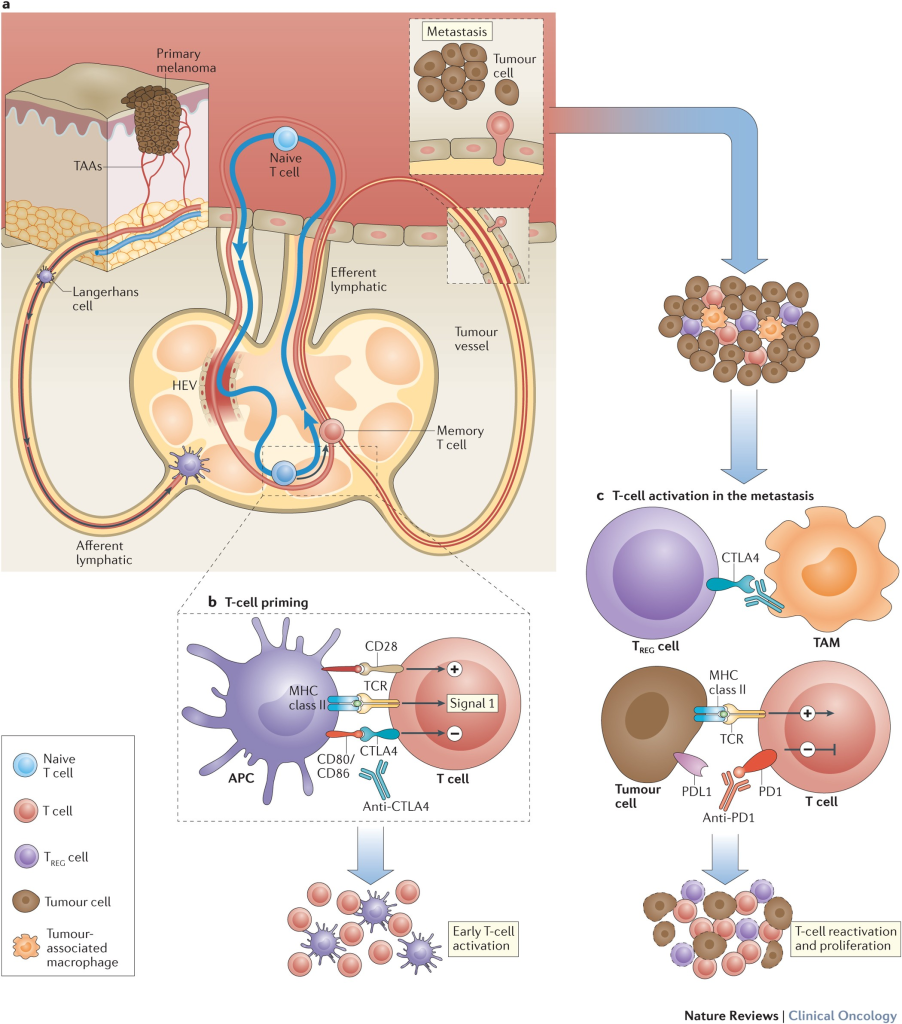
Çalışma, bağışıklık hücrelerinin kanser hücrelerini öldürmesini engelleyen düzenleyici mekanizmaları bloke eden anti-CTLA-4 adlı bir ICI’nin etkinliğini test etmiştir. Araştırmacılar, tümör taşıyan LN’ye (tbLN) ve tümör taşımayan LB’ye (ntbLN) ultrason kılavuzluğunda lenfatik ilaç iletimi ve karın boşluğuna intraperitoneal (ip) enjeksiyon dahil olmak üzere üç farklı CTLA-4 blokajı iletim yöntemini test etmiştir. Çalışma, anti-CTLA-4’ün tbLN’ye verilmesinin, daha fazla farenin tam yanıt elde etmesi ve genel sağkalımın uzaması dahil olmak üzere en güçlü yanıtı ortaya çıkardığını ortaya koymuştur. Buna ek olarak, CTLA-4 blokajının tbLN’ye verilmesi karaciğer ve akciğerlere metastatik yayılımı önlemiştir.

Daha ileri analizler, tbLN’yi hedefleyen anti-CTLA-4 ile tedavi edilen farelerin tümörlerini çevreleyen alanda, anti-tümör bağışıklık yanıtının temel oyuncuları olan CD8+ sitotoksik T hücrelerinin zenginleştiğini ortaya koymuştur. CD8 T hücrelerinin varlığı, çeşitli kanser türlerinde anti-CTLA-4 yanıtı için hem prognostik bir gösterge hem de öngörücü bir biyobelirteç görevi görmektedir. Ayrıca, anti-tümör bağışıklık yanıtının temel bir düzenleyicisi olan IFNγ sitokininin birikimi, tbLN’ye CTLA-4 blokajı uygulanan farelerde artmıştır.
Anti-CTLA-4 ile tedavi edilen farelerde irAE’lerin başlangıcı araştırılırken, ip anti-CTLA-4 alanlar, yüksek morbidite ve mortalite ile ilişkili bir yan etki olan interstisyel pnömoni dahil olmak üzere en ciddi etkileri sergilemiştir.
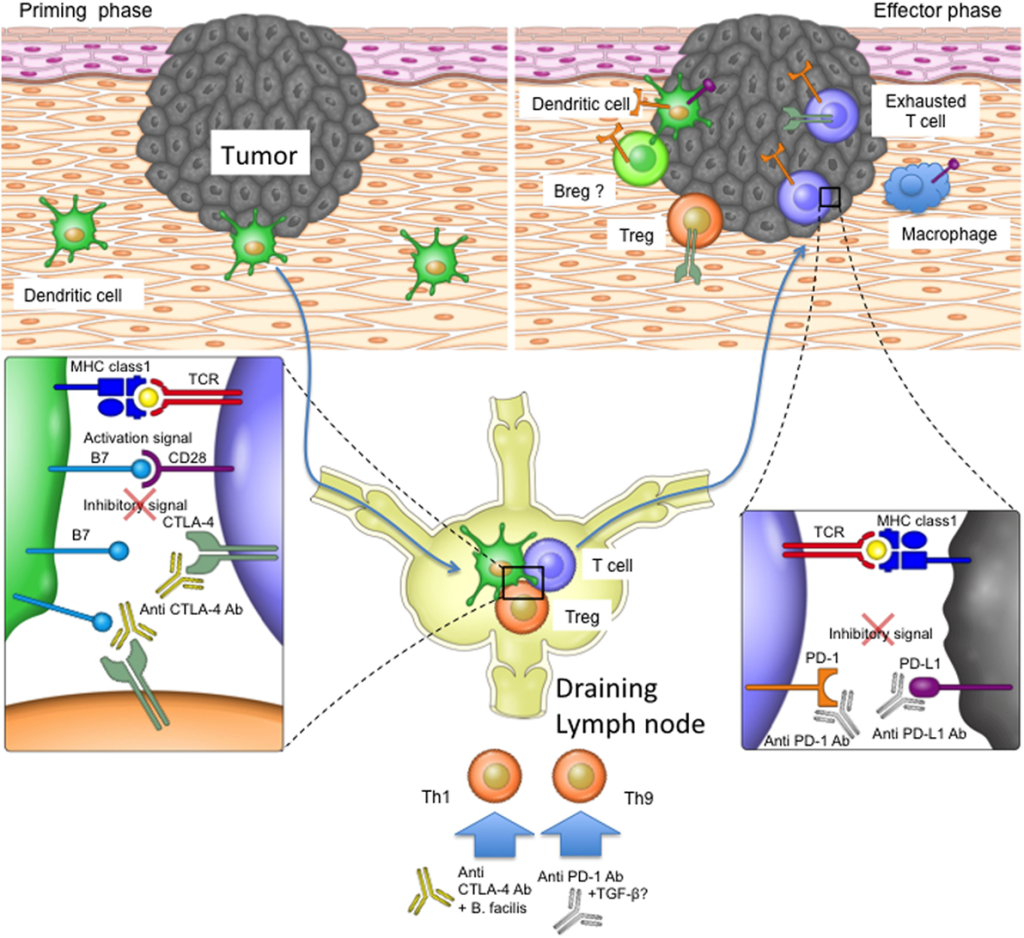
Yazarlar, fare modellerinde tbLN’ye yönelik CTLA4 blokajının hem metastazın azalması ve sağkalım süresinin uzamasıyla kanıtlandığı üzere tedavi etkinliğini artırdığı hem de irAE’lerin şiddetini azalttığı sonucuna varmıştır. Bu çalışma, klinik çalışmalarda olası uygulamalara yol açabilecek bu yaklaşımların daha fazla incelenmesi için bir gerekçe sunmaktadır.
Kaynaklar: Nature Comm, J Clin Exp Clinc Cancer Res, J Hematol Oncol, J Immunoth Cancer, Int J Molec Sci, Allergy, JAMA Oncol