Kemoterapi en yaygın kullanılan kanser tedavilerinden biridir; ancak kemoterapi sıklıkla ciddi yan etkilere neden olmaktadır. Antikor-ilaç konjugatları (ADC’ler), küçük moleküllü sitotoksinlerin etkili öldürme gücünü ve monoklonal antikorların (mAb’ler) son derece spesifik hedefleme yeteneğini birleştiren, umut verici bir şekilde ortaya çıkan kanser tedavileridir. Böylece, ADC’ler sitotoksinleri tümör hücrelerine hassas bir şekilde iletirken, normal hücreleri minimum düzeyde etkiler. ADC’ler, antikanser ilaç geliştirme için önemli bir silah haline gelmiştir (1,2).
İlk nesil ADC olan gemtuzumab ozogamicin, 2000 yılında ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylanmıştır. O zamandan bu yana, dünya çapında birden fazla ADC onaylanmış ve 100’den fazla ADC adayı klinik aşamaya girmiştir Bu yeni antikanser ilaçlar yeni bir kanser tedavisi yöntemine öncülük etmektedir.

ADC’lerin Temel Bileşenleri
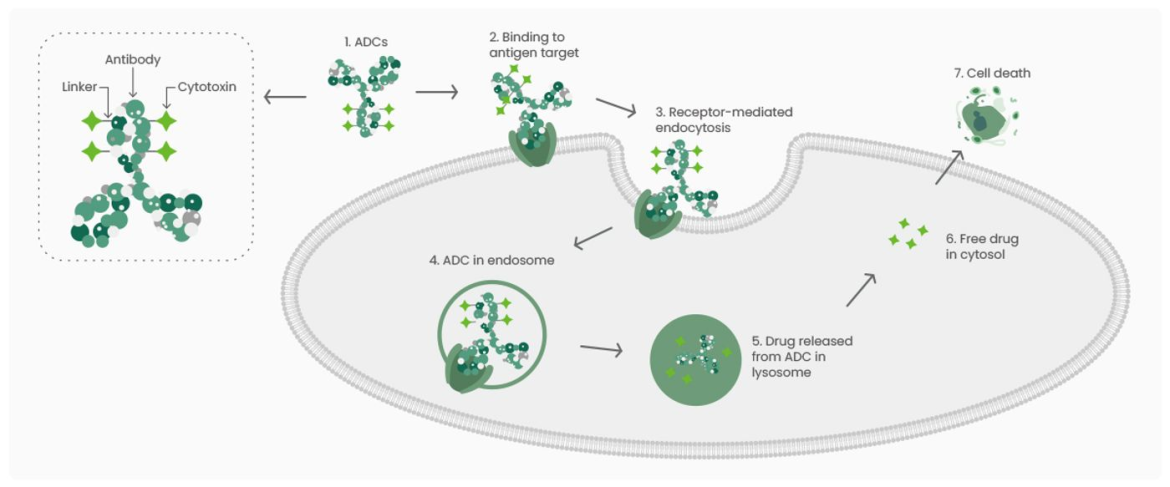
Bir ADC, hedefe özgü bir mAb, sitotoksik bir yük ve toksin ile antikoru kovalent olarak bağlayan kimyasal olarak sentezlenmiş bir bağlayıcıdan oluşur. mAb, tümör hücrelerinin yüzeyindeki spesifik antijenlere bağlanır ve ADC’ler, antikor-antijen komplekslerinin oluşumu ile tümör hücrelerine girer. ADC’ler tipik olarak endozomdan lizozoma taşınır, burada bağlayıcı parçalanır ve küçük moleküllü sitotoksinler serbest kalarak tümör hücresi ölümüne yol açar(3). Genel olarak, ADC geliştirme hedef antijenlerin, antikorların, sitotoksik küçük molekül ilacı ve bağlayıcıyı bir araya getirmeyi gerektirir (Şekil 1).
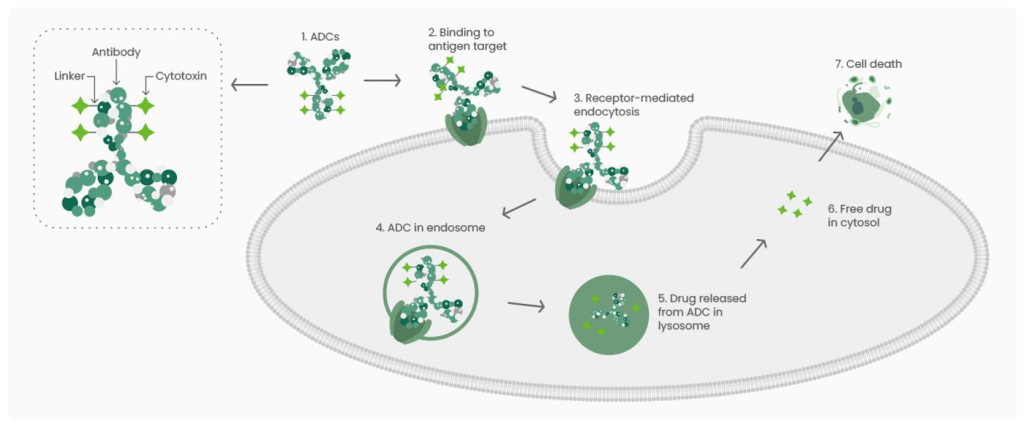
Hedef Antijenler
Hedef antijenler salgısal olmamalı, esas olarak tümör hücresi yüzeyinde ifade edilmeli ve normal dokularda düşük seviyelerde ifade edilmelidir. Buna ek olarak, hedef antijenler, ADC-antijen komplekslerinin tümör hücrelerine girişini kolaylaştırmak ve sitotoksik yükleri uygun bir hücre içi translokasyon yolu ile hücre içerisinde serbest bırakmak için ilgili antikorlara bağlandıktan sonra hücre içine giriş mekanizmalarını aktive etmelidir (4).
Şu anda, onaylanmış ADC ilaçları için hedef antijenler, solid tümörlerde HER2, Trop2, Nectin4 ve EGFR ve hematolojik malignitelerde CD19, CD22, CD33, CD30, BCMA ve CD79 dahil olmak üzere tümör hücrelerinde aşırı eksprese edilen spesifik proteinlerdir. EpCAM, CD70, CD25, CD166 ve diğerleri gibi yeni hedefler geliştirilme aşamasındadır ve umut verici sonuçlar göstermektedir (5). Sino Biological, ADC hedef antijenleri için iyi seçenekler sağlayarak ADC terapi alanının ön saflarında yer almaktadır.

Antikorlar
İmmünoglobulinler (IgG’ler) ve türevleri klinik çalışmalarda yaygın olarak kullanılmaktadır. IgG1, IgG2 ve IgG4, özgüllükleri, hedef antijene afiniteleri ve dolaşımdaki uzun yarı ömürleri nedeniyle ADC’ler için esas olarak kullanılmaktadır. Buna ek olarak, antikorlar etkili hücre içine giriş yeteneğine ve düşük immünojenisiteye sahip olmalıdır (6).
Erken ADC ilaç geliştirmede, ağırlıklı olarak fare antikorları kullanılmıştır. Bununla birlikte, bu antikorlar önemli bir bağışıklık tepkisi ortaya çıkararak terapötik etkinliğin azalmasına neden olmuştur. Rekombinant teknolojinin ortaya çıkmasıyla, fare antikorlarının yerini kimerik ve insanlaştırılmış antikorlar almıştır. Günümüzde, ADC’ler giderek daha düşük immünojenisiteye sahip tamamen insanlaştırılmış antikorlar kullanmaktadır (7).
Sino Biological, tamamlayıcılık belirleyici bölge (CDR) yama teknolojisi (complementarity-determining region (CDR) grafting technology) ve bilgisayar destekli moleküler modelleme kullanarak yüksek kaliteli mAb insanlaştırma hizmetleri sunmaktadır. Buna ek olarak Sino Biological, HEK293 ve CHO hücrelerinde 2 hafta gibi kısa bir sürede, parti başına 1000 Abs’den fazla ekspresyonla yüksek verimli antikorlar üretmek için yüksek verim ve ölçek büyütme yeteneğine sahiptir.

Sitotoksik İlaç
Sitotoksinler yüksek toksisiteye, düşük immünojeniteye ve yüksek stabiliteye sahip olmalıdır. Ek olarak, sitotoksin değiştirilebilir bir fonksiyonel gruba veya mAb’yi bağlamak için bir fonksiyonel grubun eklenebileceği bir bölgeye sahip olmalıdır. Piyasada veya klinik çalışmalarda ADC ilaçları için en yaygın kullanılan sitotoksinler mikrotübül protein inhibitörleri veya DNA’ya zarar veren ajanlardır (8). Ek olarak, ilaç-antikor oranı (DAR), yani antikora bağlayıcı tarafından bağlanan ilaç moleküllerinin sayısı, ADC geliştirmede önemli bir faktördür. Düşük bir DAR ADC etkinliğini azaltabilirken, yüksek bir DAR istikrarsızlığa neden olarak hedef dışı toksisiteye yol açabilir (8,9).
Bağlayıcı
Bağlayıcı, sitotoksik yükün/ilacın dolaşım sırasında plazmadaki antikora sıkıca bağlı kalmasını sağlayarak normal dokulara veya hücrelere zarar verebilecek erken salınımı önler ve hedef tümör hücreleri içinde etkili salınımı sağlar. Bağlayıcılar bölünebilir ve bölünemez olarak sınıflandırılabilir. Bölünebilen bağlayıcılar, serbest sitotoksinleri doğru bir şekilde serbest bırakmak için dolaşım ve tümör hücreleri arasındaki çevresel farklılıklardan yararlanır. Parçalanamayan bağlayıcılar, tüm antikor-bağlayıcı yapısının lizozomal bozunmasına bağlıdır, bu da yüklü amino asitlerin yükte tutulmasına neden olur (10,11).
Zorluklar ve Perspektifler
ADC geliştirmede birçok zorluk devam etmektedir. En büyük zorluk ADC’lerin nötropeni, trombositopeni, lökopeni, anemi ve gastrointestinal etkiler gibi toksik etkileridir (4). Diğer bir zorluk ise, azalmış antijen ekspresyon seviyeleri, değişmiş hücre içi taşıma yolları ve faydalı yük direnci ile kanıtlandığı üzere, ADC’lere karşı tümör direncidir. Buna ek olarak, yükün serbest bırakılması da bir zorluktur. ADC’ler geleneksel sitotoksik ilaçlardan çok daha büyüktür ve sitotoksinin tümörlere nüfuz etme etkinliği sınırlıdır.
Bu zorlukların üstesinden gelmek için, gelecekteki ADC gelişimi aşağıdakilere odaklanmalıdır: (1) yük platformları, bağlayıcılar ve birleştirme stratejileri dahil olmak üzere toksisiteyi azaltmak için ADC tasarımında iyileştirmeler; (2) ADC direncini azaltmak için yük olarak iki sitotoksik ajanın kullanılması; ve (3) antitümör özgüllüğünü artırmak için bispesifik antikorlar aracılığıyla ADC hücre içi girişini ve lizozomal iletimi artırmak.

1. Fu Z, Li S, Han S, Shi C, Zhang Y. Antibody drug conjugate: the “biological missile” for targeted cancer therapy. Signal Transduct Target Ther. 7(1):93 (2022).
2. Schwach J, Abdellatif M, Stengl A. More than Toxins-Current Prospects in Designing the Next Generation of Antibody Drug Conjugates Front Biosci. Apr 26;28(4):79 (2023).
3. Tang H, Liu Y, Yu Z, et al. The Analysis of Key Factors Related to ADCs Structural Design. Front Pharmacol. 10:373 (2019).
4. Zhao P, Zhang Y, Li W, Jeanty C, Xiang G, Dong Y. Recent advances of antibody drug conjugates for clinical applications. Acta Pharm Sin B. 10(9):1589-1600 (2020).
5. Hafeez U, Parakh S, Gan HK, Scott AM. Antibody-Drug Conjugates for Cancer Therapy. Molecules. 25(20):4764 (2020).
6. Zhang X, Huang AC, Chen F, et al. Novel development strategies and challenges for anti-Her2 antibody-drug conjugates. Antib Ther. 5(1):18-29 (2022).
7. Khongorzul P, Ling CJ, Khan FU, Ihsan AU, Zhang J. Antibody-Drug Conjugates: A Comprehensive Review. Mol Cancer Res. 18(1):3-19 (2020).
8. Abuhelwa Z, Alloghbi A, Nagasaka M. A comprehensive review on antibody-drug conjugates (ADCs) in the treatment landscape of non-small cell lung cancer (NSCLC). Cancer Treat Rev. 106:102393 (2022).
9. Sheyi R, de la Torre BG, Albericio F. Linkers: An Assurance for Controlled Delivery of Antibody-Drug Conjugate. Pharmaceutics. 14(2):396 (2022).
10. Tong JTW, Harris PWR, Brimble MA, Kavianinia I. An Insight into FDA Approved Antibody-Drug Conjugates for Cancer Therapy. Molecules. 26(19):5847(2021)
11. Ungaro A, Tucci M, Audisio A, et al. Antibody-Drug Conjugates in Urothelial Carcinoma: A New Therapeutic Opportunity Moves from Bench to Bedside. Cells. 11(5):803 (2022).
12. Yu J, Fang T, Yun C, Liu X, Cai X. Antibody-Drug Conjugates Targeting the Human Epidermal Growth Factor Receptor Family in Cancers. Front Mol Biosci. 9:847835 (2022).